Атомная и молекулярная структура
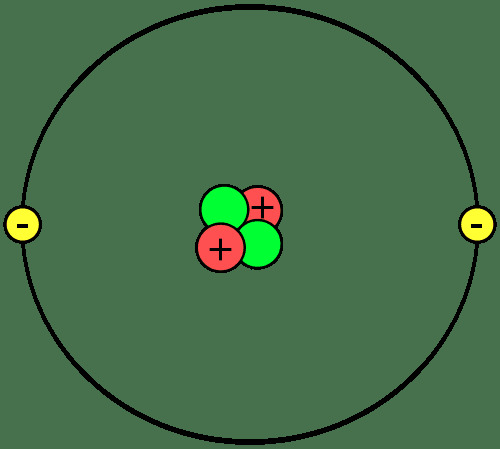
Строительными блоками материи являются атомы, которые объединяются, образуя молекулы или соединения. Важно знать части атома, что такое ионы и изотопы, и как атомы объединяются.
Части атома
Атомы состоят из трех компонентов:
- протоны - положительный электрический заряд
- нейтроны - без электрического заряда
- электроны - отрицательный электрический заряд
Протоны и нейтроны образуют ядро или центр каждого атома. Электроны вращаются вокруг ядра. Итак, ядро каждого атома имеет суммарный положительный заряд, а внешняя часть атома имеет суммарный отрицательный заряд. В химических реакциях атомы теряют, получают или делят электроны. Ядро не участвует в обычных химических реакциях, хотя ядерный распад и ядерные реакции могут вызвать изменения в атомном ядре.
Атомы, ионы и изотопы
Количество протонов в атоме определяет, какой это элемент. Каждый элемент имеет одну или две буквы
символ это используется для идентификации его в химических формулах и реакциях. Символом для гелия является Он. Атом с двумя протонами является атомом гелия независимо от того, сколько у него нейтронов или электронов. Атом может иметь одинаковое количество протонов, нейтронов и электронов, или число нейтронов и / или электронов может отличаться от количества протонов.Атомы, которые несут чистый положительный или отрицательный электрический заряд ионы. Например, если атом гелия потеряет два электрона, у него будет суммарный заряд +2, что будет записано как He2+.
Изменение количества нейтронов в атоме определяет, какие изотоп элемента это так. Атомы могут быть написаны с ядерными символами, чтобы идентифицировать их изотоп, где число нуклонов (протоны плюс нейтроны) выше и слева от символа элемента, с числом протонов, перечисленных ниже и слева от символ. Например, тремя изотопами водорода являются:
11ЧАС, 21ЧАС, 31ЧАС
Поскольку вы знаете, что число протонов никогда не изменяется для атома элемента, изотопы чаще всего записываются с использованием символа элемента и количества нуклонов. Например, вы можете написать H-1, H-2 и H-3 для трех изотопов водорода или U-236 и U-238 для двух распространенных изотопов урана.
Атомный номер и атомный вес
атомный номер атома идентифицирует его элемент и число протонов. атомный вес это число протонов плюс число нейтронов в элементе (потому что масса электронов настолько мала по сравнению с массой протонов и нейтронов, что она, по сути, не считается). Атомный вес иногда называют атомной массой или атомной массой. Атомный номер гелия равен 2. Атомный вес гелия составляет 4. Обратите внимание, что атомная масса элемента в периодической таблице не является целым числом. Например, атомная масса гелия задается как 4,003, а не 4. Это связано с тем, что периодическая таблица отражает естественное количество изотопов элемента. В химических вычислениях вы используете атомную массу, указанную в периодической таблице, предполагая, что образец элемента отражает естественный диапазон изотопов для этого элемента.
Молекулы
Атомы взаимодействуют друг с другом, часто образуя химические связи друг с другом. Когда два или более атома связываются друг с другом, они образуют молекулу. Молекула может быть простой, такой как H2или более сложный, такой как C6ЧАС12О6. Индексы указывают количество атомов каждого типа в молекуле. Первый пример описывает молекулу, образованную двумя атомами водорода. Второй пример описывает молекулу, образованную 6 атомами углерода, 12 атомами водорода и 6 атомами кислорода. Хотя вы можете писать атомы в любом порядке, условием является сначала написать положительно заряженное прошлое молекулы, а затем отрицательно заряженную часть молекулы. Итак, хлорид натрия записан NaCl, а не ClNa.
Периодическая таблица Примечания и обзор
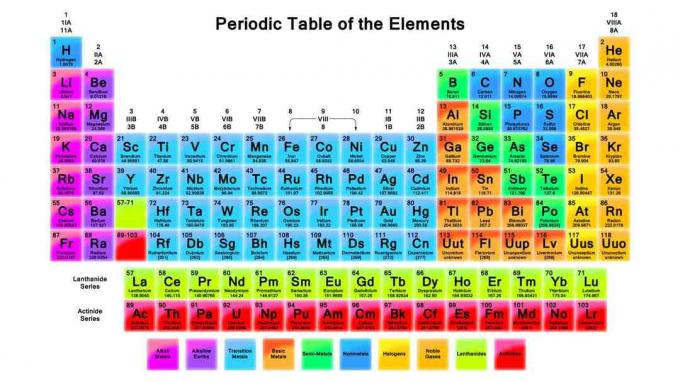
Периодическая таблица является важным инструментом в химии. Эти примечания рассматривают периодическую таблицу, как это организовано, и тенденции периодической таблицы.
Изобретение и организация периодической таблицы
В 1869 году Дмитрий Менделеев организовал химические элементы в периодическую таблицу так же, как мы используем сегодня, за исключением его элементов были упорядочены в соответствии с увеличением атомного веса, в то время как современный стол организован путем увеличения атомного веса число. То, как элементы организованы, позволяет увидеть тенденции в свойствах элементов и предсказать поведение элементов в химических реакциях.
Строки (двигаясь слева направо) называются периодов. Элементы в периоде имеют тот же самый высокий уровень энергии для невозбужденного электрона. По мере увеличения размера атома на каждом энергетическом уровне появляется больше подуровней, поэтому в периоды, расположенные дальше по таблице, появляется больше элементов.
Столбцы (перемещение сверху вниз) образуют основу для элемента группы. Элементы в группах имеют одинаковое количество валентных электронов или расположение внешней электронной оболочки, что дает элементам в группе несколько общих свойств. Примерами групп элементов являются щелочные металлы и благородные газы.
Периодическая таблица Тенденции или Периодичность
Организация периодической таблицы позволяет сразу увидеть тенденции изменения свойств элементов. Важные тенденции связаны с атомным радиусом, энергией ионизации, электроотрицательностью и сродством к электрону.
-
Радиус атома
Атомный радиус отражает размер атома. Радиус атома уменьшает движение слева направо через период и увеличивает движение сверху вниз вниз по группе элементов. Хотя вы можете подумать, что атомы просто станут больше по мере того, как они получат больше электронов, электроны остаются в оболочке, а растущее число протонов притягивает оболочки ближе к ядру. Двигаясь вниз по группе, электроны находятся дальше от ядра в новых энергетических оболочках, поэтому общий размер атома увеличивается. -
Энергия ионизации
Энергия ионизации - это количество энергии, необходимое для удаления электрона из иона или атома в газовом состоянии. Энергия ионизации увеличивает движение слева направо через период и уменьшает перемещение сверху вниз вниз по группе. -
Электроотрицательность
Электроотрицательность - это мера того, насколько легко атом образует химическую связь. Чем выше электроотрицательность, тем выше притяжение связывать электрон. Электроотрицательность уменьшает движение вниз по группе элементов. Элементы в левой части таблицы Менделеева имеют тенденцию быть электроположительными или с большей вероятностью пожертвовать электрон, чем принять один. -
Электронное сродство
Сродство к электрону отражает, насколько легко атом примет электрон. Сродство к электрону варьируется в зависимости от группы элементов. Благородные газы имеют сродство к электрону вблизи нуля, потому что они заполнены электронными оболочками. Галогены имеют высокое сродство к электрону, потому что добавление электрона дает атому полностью заполненную электронную оболочку.
Химические Связи и Связывание

Химические связи легко понять, если иметь в виду следующие свойства атомов и электронов:
- Атомы ищут наиболее стабильную конфигурацию.
- Правило октета гласит, что атомы с 8 электронами на внешней орбите будут наиболее стабильными.
- Атомы могут делиться, отдавать или брать электроны других атомов. Это формы химических связей.
- Связи возникают между валентными электронами атомов, а не внутренними электронами.
Типы химических связей
Два основных типа химических связей - это ионные и ковалентные связи, но вы должны знать о нескольких формах связей:
-
Ионные облигации
Ионные связи образуются, когда один атом берет электрон от другого атома. Пример: NaCl образован ионной связью, где натрий передает свой валентный электрон хлору. Хлор - это галоген. Все галогены имеют 7 валентных электронов и нуждаются в еще одном, чтобы получить стабильный октет. Натрий является щелочным металлом. Все щелочные металлы имеют 1 валентный электрон, который они легко жертвуют для образования связи. -
Ковалентные связи
Ковалентные связи образуются, когда атомы делятся электронами. Действительно, основное отличие заключается в том, что электроны в ионных связях более тесно связаны с одним атомом. ядро или другое, электроны которого в ковалентной связи примерно одинаково вероятны, чтобы вращаться вокруг одного ядра как Другой. Если электрон более тесно связан с одним атомом, чем другой, полярная ковалентная связь может сформироваться. Пример: образуются ковалентные связи между водородом и кислородом в воде, Н2О. -
Металлическая связь
Когда оба атома являются металлами, образуется металлическая связь. Разница в металле заключается в том, что электронами может быть любой атом металла, а не только два атома в соединении. Пример. Металлические связи видны в образцах чистых элементарных металлов, таких как золото или алюминий, или сплавов, таких как латунь или бронза.
Вам может быть интересно, как вы можете определить, является ли связь ионной или ковалентной. Вы можете посмотреть на размещение элементов в периодической таблице или таблице элементов электроотрицательности предсказать тип связи, которая будет формироваться. Если значения электроотрицательности сильно отличаются друг от друга, образуется ионная связь. Обычно катион представляет собой металл, а анион - неметалл. Если оба элемента являются металлами, ожидайте, что металлическая связь сформируется. Если значения электроотрицательности схожи, следует ожидать образования ковалентной связи. Связи между двумя неметаллами являются ковалентными связями. Полярные ковалентные связи образуются между элементами, которые имеют промежуточные различия между значениями электроотрицательности.
Как называть соединения - химическая номенклатура
Для того, чтобы химики и другие ученые могли общаться друг с другом, Международный союз теоретической и прикладной химии или ИЮПАК согласовал систему номенклатуры или наименований. Вы услышите химические вещества, называемые их общими названиями (например, соль, сахар и пищевая сода), но в лаборатории вы будете использовать систематические названия (например, хлорид натрия, сахароза и бикарбонат натрия). Вот обзор некоторых ключевых моментов о номенклатуре.
Именование бинарных соединений
Соединения могут состоять только из двух элементов (бинарных соединений) или из более чем двух элементов. Определенные правила применяются при именовании бинарных соединений:
- Если один из элементов является металлом, он называется первым.
- Некоторые металлы могут образовывать более одного положительного иона. Обычно ионный заряд указывается римскими цифрами. Например, FeCl2 является хлоридом железа (II).
- Если вторым элементом является неметалл, именем соединения является название металла, за которым следует основа (сокращение) неметаллического имени, за которой следует «ide». Например, NaCl называется хлоридом натрия.
- Для соединений, состоящих из двух неметаллов, более электроположительный элемент назван первым. Ствол второго элемента назван, сопровождаемый "ide". Примером является HCl, который является хлористым водородом.
Наименование ионных соединений
В дополнение к правилам именования бинарных соединений существуют дополнительные соглашения об именах для ионных соединений:
- Некоторые многоатомные анионы содержат кислород. Если элемент образует два оксианиона, один с меньшим количеством кислорода заканчивается в -ите, а другой с большим количеством оксиена заканчивается в -ате. Например:
НЕТ2- нитрит
НЕТ3- это нитрат